Урок по химии «Кислоты» 8 класс в технологии модульного обучения
Автор: Данилова Ирина Сергеевна
Организация: МБОУ СОШ №21 г.Коврова
Населенный пункт: Владимирская область, город Ковров
Остановимся на теоретических аспектах технологии модульного обучения.
Актуальность использования технологии модульного обучения в современной школе связана с введением Федеральных государственных образовательных стандартов нового поколения [3], которые выдвигают цель формирования у школьников опыта самоорганизации в познавательной деятельности.
Ряд ученых, занимающихся изучением модульной технологии [1; 5], выделяют следующие достоинства этой технологии:
- цели обучения точно соотносятся с достигнутыми результатами каждого обучающегося благодаря выделению иерархии целей;
- разработка модулей позволяет уплотнить учебную информацию и представить ее блоками;
- освобождение педагога от чисто информационной функции преподавания и создание условий для более яркого проявления консультативно – координирующей функции;
- поэтапный контроль знаний и умений;
- возможность осуществления уровневой дифференциации на основе обязательных результатов обучения;
- нацеленность не столько на усвоение предметных умений и навыков, сколько на метапредметность в достижении результатов обучения;
- деятельность учащегося проходит в зоне ближайшего развития, ориентирована на самоуправление и взаимоуправление, формирует навыки общения, реализует рефлексивные способности на каждом этапе занятия;
- возможность использования рейтингового контроля для избавления обучающегося от страха получения неудовлетворительной отметки.
Центральным понятием модульной технологии является понятие «модуль». Сама концепция модульного обучения была разработана американским исследователем Дж.Расселом в 60-ые гг. XX века. Он определял модуль как «учебный пакет, охватывающий концептуальную единицу учебного материала и предписанных учащимся действий» [2, с. 15]. В отечественной педагогике проблемой модульного обучения занимались П.А. Юцевичене, М.А. Чошанов, С.Я. Батышев, В.А. Ярмоленко, Т.И. Шамова, В.Ф. Шаталов, И.Б. Сенновский, П.И. Третьяков. Одним из первых авторов, кто обосновал сущность и методические основы модульного обучения, разработал принципы и правила модульного обучения была П.А. Юцевичене, которая в 1972 году дала определение модулю как «целевому, структурно – функциональному узлу, в котором учебное содержание и технология овладения им объединены в систему высокого уровня целостности» [6, с.21].
Следует отметить, что модуль обязательно должен включать в себя три компонента. Во-первых, целевую программу действий, во-вторых, банк информации (список оборудования и материалов; задания, которые обеспечивают непрерывность внутрипредметных и межпреметных связей, дифференцированы по уровню познавательной деятельности и содержанию, проблемны и нацелены на поиск проблем и их решений) и, в-третьих, методическое руководство по достижению поставленных дидактических целей [4].
Применение в практике современной школы модульного обучения является актуальным в связи с тем, что представляет собой самоуправляемый рефлексивный образовательный процесс, цель которого состоит в содействии развитию самостоятельности учащихся, их умению работать с учетом индивидуальных способов проработки учебного материала.
Учеными выделен ряд научных идей, на которых базируется технология модульного обучения. Во-первых, рассматриваемая технология строится на деятельностном принципе, суть которого заключается в том, что учебное содержание только тогда усваивается осознанно, когда оно становится предметом активных и системных действий школьников. Во-вторых, модульная технология базируется на идеях развивающего обучения, когда обучающийся способен переходить из зоны ближайшего развития в зону актуального развития. В-третьих, модульная технология реализуется на идеях дифференцированного обучения [4].
Наиболее полно и детализировано лежащие в основе модульного обучения принципы были выделены П.А. Юцевичене. Главным принципом, на который опираются все остальные принципы (принцип структуризации, динамичности, разносторонности методического консультирования, паритетности субъект-субъектных отношении и др.), является принцип модульности. Еще одним немаловажным принципом при построении модульных программ служит принцип осознанной перспективы, следование которому предполагает понимание и осознание обучающимися близких, средних и отдаленных перспектив учения. На практике это положение сводится к тому, что изучение темы по учебному предмету представляет собой пирамиду целей: в вершине пирамиды – комплексная дидактическая цель, которая ставится ко всей теме; в середине – интегрирующая цель, которая ставится ко всему учебному модулю; и в основании пирамиды – частные дидактические цели, которые уже относятся к каждому учебному элементу модуля [6].
На основании вышеизложенных принципов модульную программу можно схематически представить в виде схемы, изображенной на рис.1.
Для построения модульной программы по предмету необходимо разделить весь объем учебного материала на темы, к каждой из которых формулируется комплексная дидактическая цель (КДЦ). Затем в каждой теме выделяется необходимое число модулей, к каждому выделенному модулю ставится интегрирующая дидактическая цель (ИДЦ). И в завершении, в каждом модуле выделяют учебные элементы с обозначенными частными дидактическими целями (ЧДЦ).
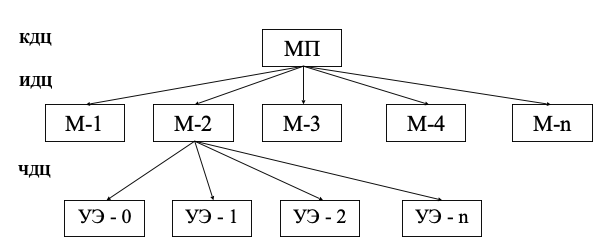
Рис.1. Схема модульной программы
П.А. Юцевичене [6]предлагает в каждом модуле выделять 7 учебных элементов, каждый из которых имеет свое название, цель, учебное содержание и рефлексивный компонент:
1) УЭ-0 – интегрирующая цель или цель всего модуля;
2) УЭ-1 – входной контроль (определение исходного уровня знаний по изучаемой теме с помощью тестовых заданий и вопросов);
3) УЭ-2,3,4 – изучение нового материала с помощью разных форм работы, обеспечивающих прохождение всех ступеней усвоения учебного материала от восприятия через осмысление к пониманию;
4) УЭ-5 – выходной контроль (определение уровня усвоения модуля);
5) УЭ-6 – резюме (подведение итогов);
6) УЭ-7 – рефлексия.
Таким образом, теоретический анализ технологии модульного обучения позволяет сделать вывод о целесообразности ее использования в современной школе в рамках различных учебных предметов, поскольку ее целевые ориентиры соответствуют требованиям ФГОС.
В рамках технологии модульного обучения было разработано ряд уроков для 8 класса, один из которых по теме «Кислоты» представлен ниже.
Модульный урок по химии 8 класс.
|
Учебный элемент |
Учебный элемент с указанием заданий |
Рекомендации по выполнению заданий |
|
УЭ – 0 Формулировка темы урока. Определение цели урока. |
Задание 1. Прочитайте текст и ответьте на вопросы после текста. Текст Самой первой кислотой, которую удалось выделить и использовать человечеству, конечно, была уксусная кислота. Сам термин «кислота» (от латинского «acid») произошел от латинского «acetum» - уксус. С кислотами мы сталкиваемся постоянно как на кухне (например, уксусная, лимонная, аскорбиновая), так и в природе. Лимонную кислоту получают не только из лимонов (25 кг кислоты на 1 т лимонов), но и из плесневого гриба Aspergillusniger.Витамин С или аскорбиновая кислота является водорастворимым витамином, который участвует в биохимических окислительно – восстановительных процессах человеческого организма. В дождевой воде присутствуют угольная кислота, которая образуется при растворении углекислого газа CO2 в ней; азотная кислота, которая образуется из оксидов азота после грозы. Еще одна кислота – серная образуется после извержения вулканов, а также голожаберные моллюски способны испускать пары серной кислоты для зашиты от врагов. Важным ингредиентом популярной Кока-Колы является фосфорная (или ортофосфорная) кислота с очень высоким показателем кислотности pH = 2,8. Вопросы:
Сформулируйте тему нашего урока: _______________
Цель урока: обобщить и углубить знания о составе и классификации кислот, изучить их физические и химические свойства.
|
Прочитайте внимательно текст и отметьте те вещества, о которых идет речь в тексте.
На основании текста и ответов на вопросы сформулируйте тему урока и запишите в тетрадь. Подумайте, что Вам даст достижение этой цели? Что нового Вы узнаете? |
|
УЭ – 1 Входной контроль. |
Цель этапа: вспомнить основные классы неорганических веществ и отличительные признаки каждого из этих классов.
Задание 2. Пройдите химический лабиринт, выбрав верный путь от старта к финишу. (Приложение 1)
Исходя из формул кислот, дайте определение, что такое кислота.
|
Для правильного распределения веществ по классам неорганических соединений воспользуйтесь схемой. СХЕМА оксиды основания
кислоты соли HnК.О .Mx(К.О.)y
Что узнали после этапа «Входной контроль»? |
|
УЭ – 2 Ввод нового материала. |
Цель этапа: рассмотреть классификацию неорганических кислот.
Задание 3. Выявите фактор, который лежит в основе классификации кислот в каждом из 4-ех случаев. 1) кислоты 2) кислоты 3)кислоты 4) кислоты Фактор ? Фактор? Фактор? Фактор?
HCl HNO3 HCl H2SO4 H3PO4 H2S H2SiO3 HCl H2CO3 HI H2SO4 HCl H2SO4 H2SO3 HNO3
|
Для определения фактора, лежащего в основе классификации, воспользуйтесь Таблицей растворимости и Теорией электролитической диссоциации.
Что Вы узнали после рассмотрения учебного элемента – 2? Что нам осталось изучить для достижения поставленной цели урока? |
|
УЭ – 3 Изучение нового материала |
Цель этапа: изучить какими физическими и химическими свойствами обладают кислоты.
Задание 4. Установите соответствие между названием кислоты, рисунком и ролью кислоты. Ответ запишите в виде цифра – буква – цифра.
безалкогольной промышленности
СН3
регулятора кислотности в пищевой промышленности
Задание 5.Прочитайте текст и выделите основные физические свойства кислот. Текст Благодаря наличию ионов Н+ все кислоты кислые на вкус. Мы ощущаем этот вкус за счет лимонной кислоты в лимонах, за счет яблочной кислоты в яблоках, за счет аскорбиновой кислоты в смородине и шиповнике. Это органические вещества – продукты живой природы. Можно ли пробовать на вкус неорганические кислоты (HCl, HNO3, H2SO4)? Конечно, нет. Они вызывают сильные ожоги и отравления. Все неорганические кислоты растворимы в воде, кроме H2SiO3, и являются или бесцветными жидкостями (H2SO4, HCl, HNO3), или твердыми веществами, например, фосфорная кислота – H3PO4.
Задание 6. Закончите уравнения реакций и заполните схему.
Запишите уравнение в полном и кратком ионном виде.
Схема
|
Выполните взаимопроверку по результатам работы.
Запишите в тетрадь выделенные физические свойства кислот.
При написании химических уравнений помните:
С какими веществами могут вступать в реакции неорганические кислоты?
|
|
УЭ – 4 Этап включения полученных знаний в систему уже имеющихся. |
Цель этапа: использовать полученные знания о кислотах в решении задачи на нахождение массовой доли растворенного вещества.
Задание 6. Решите задачу. Для оказания первой помощи при ожоге серной кислотой необходимо вовремя промыть обожженный участок кожи водой, после чего обработать 2%-ным раствором пищевой соды (NaHCO3–гидрокарбонат натрия). Вопрос:рассчитайте, сколько граммов пищевой соды и воды нужно взять для приготовления 110 мл (ρ = 2,24 г/мл) 2%-ного раствора пищевой соды NaHCO3? Сколько необходимо взять чайных ложек пищевой соды, если 1 чайная ложка вмещает 5 г?
По окончании урока учащиеся заполняют лист самооценки «Дерево роста» (Приложение 2), на котором отмечают следующее: - если тема была полностью понятна, то закрашивают человечка полностью; - если остались какие-то вопросы, то закрашивают человечка наполовину; - если же возникли большие трудности при прохождении материала, то закрашивают только ноги. Данный лист самооценки целесообразно использовать на каждом уроке. |
Для решения задачи воспользуйтесь формулами: mраствора = V·ρ
ɷ(растворенного вещества). =
Сможете ли Вы применять полученные на уроке знания в повседневной жизни?
Была ли достигнута цель урока? |
|
УЭ – 5 Домашнее задание. |
§39 «Кислоты, их классификация и свойства», выучить конспект, упр. 1-4 |
|
Полный текст статьи см. в приложении.






