Урок по химии в 9 классе «Окислительно-восстановительные реакции. Метод электронного баланса»
Автор: Богатова Валентина Ильинична
Организация: МБОУ «Ивановская СШ»
Населенный пункт: Красноярский край, с. Ивановка
- Фамилия, имя, отчество автора: Богатова Валентина Ильинична
- Место работы: Муниципальное бюджетное общеобразовательное учреждение «Ивановская средняя школа» с. Ивановка
- Должность: учитель химии
- Класс: 9
- Предмет: химия
- Тема урока: Окислительно-восстановительные реакции. Метод электронного баланса.
- Место урока в теме и в программе по предмету: Обобщение знаний по химии за курс основной школы (10 часов). Данная тема изучается в рамках закрепления ранее изученной в 8 классе темы «Окислительно-восстановительные реакции».
- Ключевая идея урока в формате проблемного вопроса: каким образом методом электронного баланса можно расставить коэффициенты в любом уравнении окислительно-восстановительной реакции.
- Цель (прописанная через результат): к концу урока каждый ученик будет:
знать: определение окислительно-восстановительных реакций, что такое процесс окисления, восстановления, окислитель, восстановитель, алгоритм расстановки коэффициентов методом электронного баланса;
уметь: распознавать реакции по признаку изменения степеней окисления химических элементов (окислительно – восстановительные реакции и реакции, идущие без изменения степени окисления ); определять процессы окисления , восстановления, окислитель, восстановитель; использовать метод электронного баланса для расстановки коэффициентов в ОВР.
-
Инструменты и критерии/показатели/индикаторы оценки достижения запланированных результатов:
Задание №1 Самостоятельная работа. По алгоритму определить степень окисления всех химических элементов, входящих в состав веществ - 5 баллов.
Задание № 2 Работа в парах. Укажите окислительно-восстановительные реакции. (Правильные ответы: 2, 5, 7, 8) - 2 балла.
Задание№ 3 Групповая работа. Установите соответствие между схемой процесса, происходящего в окислительно-восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой. – 1 балл
СХЕМА ПРОЦЕССА НАЗВАНИЕ ПРОЦЕССА
А) S-2 → S0 1) окисление
Б) Н20→ 2Н+ 2) восстановление
В) Cr+6 → Cr+3
Задание№ 4 Лабораторный опыт. Групповая работа. Один из каждой группы у доски публично представляет результаты своей работы (по алгоритму расставляет коэффициенты в уравнении данной реакции, используя метод электронного баланса). – 3 балла.
Задание № 5 Самостоятельная работа. Расставить коэффициенты методом электронного баланса в сложном уравнении – 3 балла.
-
Организационно-педагогические условия проведения урока:
Урок систематизации знаний и умений по химии в 9 классе на тему " Окислительно-восстановительные реакции. Метод электронного баланса» разработан с использованием технологии системно-деятельностного подхода в обучении. Структура урока построена согласно методике системно-деятельностного подхода по формированию учебно-познавательных, коммуникативных и информационных компетенций обучающихся.
Содержание, методы, средства и формы организации познавательной деятельности на уроке подчинены выполнению поставленных целей и задач образования, развития и воспитания обучающихся. Для организации деятельности обучающихся на уроке были применены различные формы работы с детьми:
§ индивидуальная (при проведении самостоятельной работы)
§ фронтальная (при актуализации знаний обучающихся)
§ групповая (во время закрепления учебного материала).
Способы взаимодействия продуманы с учетом индивидуальных способностей обучающихся и их интересов. При подготовке к уроку были учтены и возрастные, и индивидуальные особенности. Из класса более половины учащихся сдают ОГЭ поэтому были подобраны задания из КИМов:
Задание № 1 № 4 и КИМов (определить степень окисления);
Задание № 2 № 11 (определить окислительно-восстановительные реакции) ;
Задание № 4 № 15 (определить процессы окисления и восстановления);
Задание № 4 № 20 (расставить коэффициенты в уравнении химической реакции методом электронного баланса).
- Организационный этап. (1 мин)
- Постановка целей и задач урока. Мотивация учебной деятельности.
Фронтальная работа.
Эвристическая беседа.
На столах у детей два гвоздя: один новый, не покрыт ржавчиной, другой ржавый.
- Что произошло со вторым гвоздем?
- Что такое химическая реакция?
Мы с вами знаем разные классификации химических реакций. К какой классификации вы бы отнесли данную?
Учащиеся отвечают на вопрос и формулируют тему урока
Тема урока «Окислительно-восстановительные реакции».
- Актуализация знаний.
Для начала, давайте вспомним, что такое степень окисления и как определяется степень окисления в простых и сложных веществах.
Степень окисления - это условный заряд атома в соединении. Степень окисления совпадает с валентностью, но в отличие от валентности степень окисления бывает отрицательной.
Алгоритм. Правила определения степеней окисления:
- У свободных атомов и у простых веществ степень окисления равна 0:
Na, H2, N2, S, Al, F2.
- Металлы во всех соединениях имеют положительную степень окисления (ее максимальное значение равно номеру группы):
а) у металлов главной подгруппы I группы +1;
б) у металлов главной подгруппы II группы +2;
в) у алюминия +3.
- В соединениях кислород имеет степень окисления -2
(исключение O+2F2 и пероксиды:H2O2-1; K2O2-1).
- В соединениях с неметаллами у водорода степень окисления +1, а с металлами -1.
- В соединениях сумма степеней окисления всех атомов равна 0.
H+1Cl-1 H2+1S-2 H2+1S+6O4-2
+1 - 1 = 0 (2 · 1) - 2 = 0 (1 · 2) + 6 - (2 · 4) = 0
Задание № 1 Самостоятельная работа. Определите степени окисления всех химических элементов, входящих в состав веществ:
NaOH, MgCl2, K2CO3, AlCl3, H3PO4
Проверка(через проектор на доске Слайд № 1 ) Na+1O-2H+1; Mg+2Cl2-1; K2+C+4O3-2 ; Al+3Cl3- ; H3+P+5O4-2
(5 баллов) - все правильно
4 балла - одна ошибка
3 балла - две ошибки
0 баллов - более двух ошибок
Задание № 2.
Дан текс. Выберите информацию и установите существенные признаки классификации химических реакций по изменению степени окисления химических элементов.
Работа в парах.
Укажите окислительно-восстановительные реакции:
- CaCO3 → CaO + CO2
- 2HgO → 2Hg + O2
- Na2O + SO2 → Na2SO3
- P2O5 + 3H2O → 2H3PO4
- C + O2 → CO2
- BaCl2 + Mg SO4 → BaSO4 +MgCl2
- Zn + 2HCl → ZnCl2 + H2
- 3Mg + N2 → Mg3N2
- Правильные ответы: 2, 5, 7, 8. (2 балла)
Учитель: определите тип реакции по числу и составу вступающих и образующихся веществ.
- Какие из этих реакций относятся к ОВР? (к ОВР относятся все реакции замещения; только те реакции соединения и разложения, в которых участвует хотя бы одно простое вещество; реакции горения).
Задание № 3
Дан текст. Проанализируйте информацию, выявите существенные признаки элементов восстановителей и элементов окислителей; процессов восстановления и окисления.
Работа в группах.
I группа
(1балл)Установите соответствие между схемой процесса, происходящего в окислительно-восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА ПРОЦЕССА НАЗВАНИЕ ПРОЦЕССА
- S-2 → S0 1) окисление
Б) Н20→ 2Н+ 2) восстановление
В) Cr+6 → Cr+3
II группа
(1балл)Установите соответствие между схемой процесса, происходящего в окислительно-восстановительной реакции, и названием этого процесса: к каждой позиции, обозначенной буквой, подберите соответствующую позицию, обозначенную цифрой.
СХЕМА ПРОЦЕССА НАЗВАНИЕ ПРОЦЕССА
- Cl-1 → Cl+5 1) окисление
Б)S0 →S+6 2) восстановление
- Fe+6 → Fe+3
Один из каждой группы у доски по слайду выражает точку зрения всей группы.
Учитель: эти процессы неразрывно связаны между собой, число принятых окислителем электронов должно быть равно числу отданных восстановителем электронов. На этом основании составляется электронный баланс и расставляются электроны.
- Обобщение и систематизация знаний.Задание № 4. Лабораторный опыт (выполняют обе группы) (3 балла)
В фарфоровую чашку с канцелярской кнопкой прилить раствор сульфата меди (II). (Для экономии времени Л О проводим в начале урока и оставляем до данного момента).
- Что наблюдаете?
- Сформулируйте вывод по результатам проведенного эксперимента.
- Запишите химическое уравнение данной реакции и по тексту изучите алгоритм составления схемы окислительно-восстановительных процессов, по алгоритму расставьте коэффициенты в уравнении данной реакции, используя метод электронного баланса.
Один из каждой группы у доски публично представляет результаты своей работы.
Задаются вопросы по существу обсуждаемой темы, дети выражают свою точку зрения.
Fe0 + Cu+2SO4 → Fe+2SO4 + Cu0
Fe0- 2e→ Fe+2 │ 2 ││ 1 │окисление ( отдал е - процеес окисления)
ок-ль 2
Cu+2 + 2e→Cu0 │ 2 ││ 1 │восстановление (взял е - процесс восстановления)
вос-ль
Учитель: Какая польза от теории ОВР? (Например, расстановка коэффициентов в сложных уравнениях – метод электронного баланса)
- Применение знаний и умений в новой ситуации.
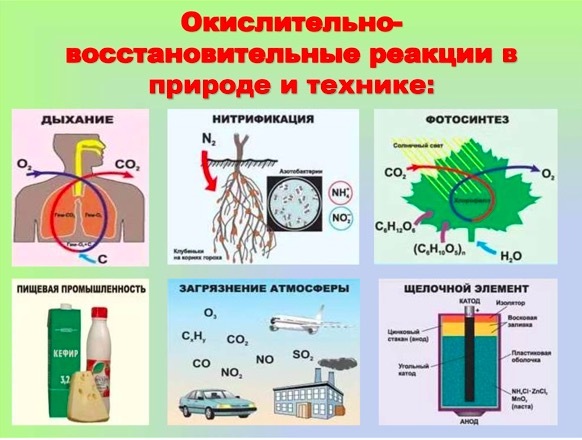
Учитель: с окислительно-восстановительными реакциями мы встречаемся и в природе, и в жизни.
Задание № 5 Индивидуальная работа. ( 3 балла).
Проанализируйте информацию на Слайде и сформулируйте четкое высказывание использования ОВР в природе и технике.(можно использовать и др. примеры - гниение плодов, выплавка металлов, извержение вулканов, дрожжевое тесто, горение костра, реакции брожения)
- Контроль усвоения, обсуждение допущенных ошибок и их коррекция.
- Рефлексия (подведение итогов).
Выскажитесь одним предложением, выбирая начало фразы из рефлексивного списка на доске:
- сегодня я узнал…
- было интересно…
- было трудно…
- я выполнял задания…
- я понял, что…
- у меня получилось …
- меня удивило…
- мне захотелось…
- Домашнее задание. (дифференцированное – одно, два или все три уравнения для тех, кто сдает экзамен по химии)
Расставьте коэффициенты с помощью электронного баланса, укажите окислитель и восстановитель в следующих реакциях:
СuS + HNO3(разб) → Cu(NO3)2 + S + NO ↑ + H2O
K2SO3 + H2SO4 + KMnO4 → K2SO4 + MnSO4 + H2O
MnO2 + HCl → MnCl2 + Cl2 + H2O
12.Перечень дидактических материалов: карточка – алгоритмк зад. № 1. Правила определения степеней окисления:
- У свободных атомов и у простых веществ степень окисления равна 0:
Na, H2, N2, S, Al, F2.
- Металлы во всех соединениях имеют положительную степень окисления (ее максимальное значение равно номеру группы):
а) у металлов главной подгруппы I группы +1;
б) у металлов главной подгруппы II группы +2;
в) у алюминия +3.
- В соединениях кислород имеет степень окисления -2
(исключение O+2F2 и пероксиды:H2O2-1; K2O2-1).
- В соединениях с неметаллами у водорода степень окисления +1, а с металлами -1.
- В соединениях сумма степеней окисления всех атомов равна 0.
H+1Cl-1 H2+1S-2 H2+1S+6O4-2
+1 - 1 = 0 (2 · 1) - 2 = 0 (1 · 2) + 6 - (2 · 4) = 0
Текст к зад. № 2


Текст к зад. № 3

Карточка – алгоритм к зад № 4

Карточка с домашним заданием
Расставьте коэффициенты с помощью электронного баланса, укажите окислитель и восстановитель в следующих реакциях:
СuS + HNO3(разб) → Cu(NO3)2 + S + NO ↑ + H2O
K2SO3 + H2SO4 + KMnO4 → K2SO4 + MnSO4 + H2O
MnO2 + HCl → MnCl2 + Cl2 + H2O
13.Критерии оценивания:
Максимальное количество баллов за все задания 13 - 14 баллов Оценка « 5 »
9 – 12 баллов « 4 »
7 – 8 баллов « 3 »
14.Оснащение урока: алгоритм расстановки степени окисления, алгоритм расстановки коэффициентов по методу электронного баланса, таблица типичных окислителей и восстановителей, канцелярские кнопки, р-р СuSO4, фарфоровая чашечка.






