Урок химии 11 класса «Электролиз»
Автор: Кузнецова Анна Николаевна
Организация: РЖД ЛИЦЕЙ № 2
Населенный пункт: Саратовская область, г.Красный Кут
Урок химии для 11го класса
«Электролиз: магия электричества в мире Гарри Поттера»
Тип урока: урок открытия нового знания
Цель урока:
Сформировать у учащихся целостное представление об электролизе как окислительновосстановительном процессе, протекающем под действием электрического тока, и продемонстрировать его практическое значение через экспериментальную деятельность в контексте вселенной Гарри Поттера.
Задачи:
- образовательные: изучить сущность электролиза, составить уравнения катодных и анодных процессов, рассмотреть области применения электролиза;
- развивающие: развить логическое мышление, умение анализировать и обобщать, навыки безопасной работы с оборудованием;
- воспитательные: повысить мотивацию к изучению химии через игровую форму, сформировать интерес к научноисследовательской деятельности.
Оборудование и реактивы:
прибор для электролиза
источник постоянного тока (6–12 В);
амперметр;
графитовые электроды;
растворы: CuSO4, KI, лакмус;
пробирки, штатив, спиртовка, спички;
защитные очки, перчатки.
Ход урока
1.Организационный момент (1мин.)
Дорогие друзья, добро пожаловать на необычный урок химии, который станет волшебным путешествием в мир электролиза вместе с героями серии книг о Гарри Поттере!
2. Мотивация и актуализация знаний (5 мин.)
Представьте себе школу чародейства и волшебства Хогвартс. Вы отправляетесь на урок зельеварения профессора Северуса Снегга. Сегодня профессор расскажет вам, как можно получать металлы с помощью волшебства, а точнее — процесса электролиза.
Диалог с классом:
Какие процессы требуют электрического тока?
Почему металлы проводят ток, а дистиллированная вода — нет?
Как можно «разложить» вещество на части с помощью электричества?
Тема нашего урока «Электролиз»
2. Изучение нового материала (10 мин)
Учитель : «В мире маглов это называют электролизом. Давайте разберёмся, как это работает!»
Основные понятия (анимация + объяснение):
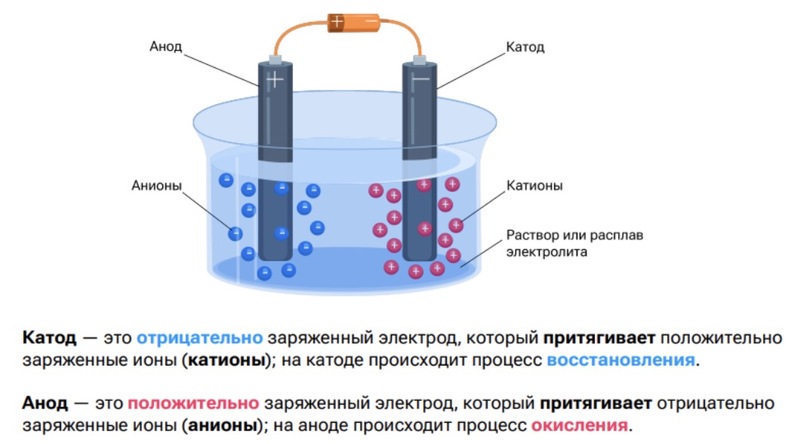
- Электролиз — окислительновосстановительный процесс на электродах при пропускании постоянного тока через расплав или раствор электролита.
- Электроды- это палочки, в данном случае, графитовые, через которые мы пропускаем электрический ток. Начинается движение электронов под действием источника постоянного тока и электроны начинают бежать с анода (+) на катод (-).
- Анод, будучи положительно заряженной палочкой, притягивает к себе отрицательно заряженные частички (это частички у которых есть электроны). Анод (+) — притягивает анионы, происходит окисление.
- Катод (−) — притягивает катионы, происходит восстановление.
«Для определения процессов, происходящих на электродах, нам понадобится ряд активности металлов. Активность металла –это то насколько он любит находится в положительной степени окисления. Элемент находится в положительной степени окисления, когда отдает электроны.
В начале ряда активности металлов находятся активные металлы, которым свои электроны не нужны, они любят отдавать свои электроны, это от лития до алюминия включительно. После водорода в ряду находятся металлы драгоценные, малоактивные. Они свои электроны отдавать не любят, поэтому не окисляются, и могут храниться долго, как например золото и серебро. Между ними металлы средней активности, как правило,это d-элементы, переходные»
- Правила разряжения ионов (кратко):
-
- На катоде: если металл после H2 в ряду напряжений — выделяется металл; если до — выделяется H2.
- На аноде: если анион бескислородный — выделяется неметалл; если кислородосодержащий — выделяется O2.


Пример (на доске): электролиз CuSO4.
• Катод: Cu2++2e−→Cu0
• Анод: 2H2O−4e−→O2↑+4H+
• Суммарно: 2CuSO4+2H2O ⟶2Cu+O2↑+2H2SO4
«Как вы думаете, мог ли Снейп использовать электролиз для получения чистого серебра для зелий?»
«А Дамблдор — для очистки воды в озере у Хогвартса?»
3.Экспериментальная часть (28 мин)
Инструктаж по технике безопасности (в форме «заклятия безопасности»):
«Protego Electricus! Не касайтесь оголённых проводов, используйте защитные очки, не пробуйте растворы на вкус!»
Опыт 1. «Золото Гриффиндора»: электролиз CuSO4
- Собрать установку: электролизер с графитовыми электродами, подключить к источнику тока.
- Налить раствор CuSO4, включить ток (сила тока ~0,5 А).
- Наблюдать: на катоде — красный налёт меди, на аноде — пузырьки газа.
- Записать уравнения процессов.
Обсуждение:
• Почему медь оседает именно на катоде?
• Что будет, если взять раствор NaCl?
Опыт 2. «Тайна фиолетового дыма»: электролиз KI с индикатором
- В электролизер налить раствор KI + несколько капель лакмуса.
- Включить ток.
- Наблюдать: у катода — синее окрашивание (щелочная среда, OH−), у анода — бурое окрашивание (выделение I2).
- Поднести влажную крахмальную бумажку к аноду — посинение (реакция I2 с крахмалом).
Уравнения:
- Катод: 2H2O+2e−→H2↑+2OH−
- Анод: 2I−−2e−→I2
Финальный вопрос:
«Если бы Гермиона использовала этот опыт для создания сигнального дыма, какой цвет она бы выбрала?»
4. Закрепление и рефлексия (4 мин)
Игра «Кто быстрее?» (работа в группах):
- Команда 1: составить уравнение электролиза NaCl (расплав).
- Команда 2: объяснить, почему при электролизе AgNO3 на катоде выделяется серебро.
- Команда 3: предложить применение электролиза в магическом мире (например, для создания светящихся зелий).
Рефлексия «Три заклинания»:
- Lumos (что нового узнал?).
- Nox (что было сложно?).
- Alohomora (как можно применить знания?).
5. Домашнее задание (2 мин)
На выбор:
- Написать эссе «Электролиз в мире Гарри Потера: 5 способов использования».
- Решить задачу: рассчитать массу меди, выделившейся при электролизе CuSO4 в течение 30 мин при силе тока 2 А.
- Подготовить минипрезентацию о промышленном применении электролиза (гальванопластика, получение алюминия и т. п.).
Завершение урока:
«Помните: настоящая магия — это знание! До встречи на следующем занятии в Хогвартсе!»
Критерии оценки:
- активность на этапе обсуждения;
- правильность составления уравнений;
- соблюдение ТБ во время эксперимента;
- креативность в «магических» приложениях электролиза.
Методический комментарий:
Использование контекста Гарри Поттера снижает тревожность, повышает вовлечённость и помогает визуализировать абстрактные процессы. Эксперименты подобраны так, чтобы наглядно демонстрировать ключевые признаки электролиза (выделение металла, газа, изменение среды)








